近日,材料领域顶尖期刊Advanced Functional Materials(IF=19.924)正式发表浦京集团药学院刘东飞教授团队最新研究成果:Surface Decoration of Peptide Nanoparticles Enables Efficient Therapy toward Osteoporosis and Diabetes。浦京集团博士研究生黄天合和硕士研究生王冠为本论文共同第一作者,刘东飞教授为本论文唯一通讯作者,350vip浦京集团为本论文唯一通讯单位。
药物与辅料经过特定包载工艺制成微粒后,大幅改善药物的体内动力学特性,延长药物的表观半衰期。在保证药物控释的前提下,提高药物载药量可有效减少辅料用量,降低给药频次,提高患者用药依从性。目前药物的高效包载多依赖于药物结构和载体结构的设计来改善两者相容性。然而,对药物分子与载体材料特定结构和官能团的要求导致难以满足不同药物的包载需求。
近日,刘东飞教授团队研究发现,将药物分子转化为药物胶体颗粒,可有效规避药物结构及理化性质的多样性,使其仅表现为胶体颗粒的表面性质。本研究通过引入荷电性载体材料,利用分子间相互作用,使胶体颗粒均表现为表面所吸附聚合物性质,进而普适性地实现胶体颗粒的表面修饰。该方法成功将艾塞那肽微球和鲑鱼降钙素微球的包封率从不足5%提升到96%以上,载药量从不足10%提高到46%以上,实现水溶性多肽微球的超高载药。载体材料对多肽纳米粒的高效包封也有望在多种药物微球共载中实现精确的比率控制。本研究成功利用表面修饰实现了鲑鱼降钙素和艾塞那肽两种带相反电荷的多肽在微球中以任意比例高效共包载。此外,吸附的载体材料固化后在多肽纳米粒表面形成聚合物层,实现了鲑鱼降钙素和艾塞那肽微球在3周内的零级释放。由于载体材料用量较少,治疗期间大鼠给药部位未出现明显炎症反应。
以上工作得到了国家自然科学基金(51903251和81973266)、江苏省自然科学基金会(BK20190554)和国家重点实验室项目计划(350vip浦京集团,SKLNMZZ202221)的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/adfm.202210627
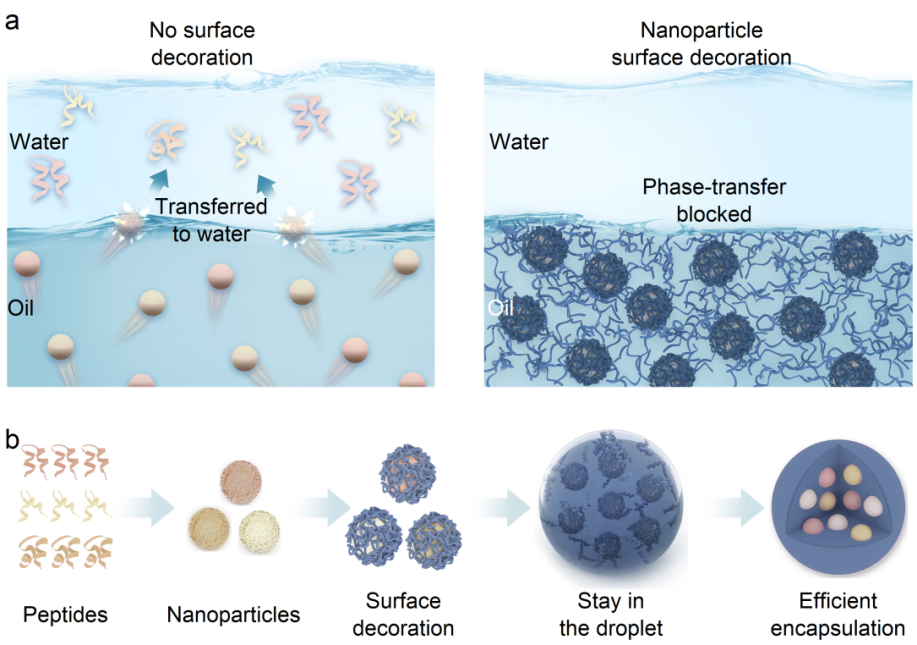
示意图 表面修饰介导多肽药物高效包载
(供稿单位:药学院,撰写人:刘华,审稿人:黄欣、郑诗翌)





