近日,共识权威期刊J Am Chem Soc发表了浦京集团理学院窦晓巍团队在轴手性联芳基结构不对称合成方面的最新研究成果:Developing Biarylhemiboronic Esters for Biaryl Atropisomer Synthesis via Dynamic Kinetic Atroposelective Suzuki−Miyaura Cross-Coupling(J. Am. Chem. Soc.2024, 146, 6283-6293)。理学院2021级硕士生杨一明和2022级博士生吴昶辉为该文的共同第一作者,理学院窦晓巍教授为该文的通迅作者,350vip浦京集团为该文的唯一作者单位。
阻转异构由分子中围绕特定单键的自由旋转受到阻碍而引起,是手性分子对映异构的一种重要形式。存在阻转异构的轴手性联芳基结构是一类重要的优势手性结构,广泛存在于手性配体、手性催化剂、手性天然产物等重要分子中;近期临床在研以及相关文献中出现的大量活性分子含有轴手性联芳基结构,表明轴手性对活性药物分子的影响已经引起药物化学家的关注。然而,保持阻转稳定的轴手性联芳基结构需要在手性轴邻位含有多取代和大位阻基团,导致该类手性结构的合成极具挑战性。因此,以轴手性联芳基结构高效精准合成为导向的新试剂和新方法开发引起了化学家的极大兴趣。
具有低阻转能垒的环状联芳基试剂可在手性催化体系下发生动态动力学不对称开环反应,为轴手性联芳基骨架的不对称合成提供了有效方法。然而,现有的环状联芳基试剂存在互补反应性缺失、结构类型受限、适用反应类型少等问题。针对这些问题,研究团队通过有机硼酸与联芳基骨架融合的策略,设计开发了一类联芳基硼酸半酯试剂,该类试剂具有与现有试剂互补的反应特性,且在过渡金属催化体系下展现出高反应活性,适用于多类型反应。在该项工作中,作者开发了联芳基硼酸半酯的钯催化动态动力学不对称Suzuki−Miyaura偶联反应,该反应具有条件温和、反应高效、底物范围广、对映选择性高等优点,为轴手性联芳基结构的高效精准合成提供了一种有效方法。此外,反应机理研究表明,与传统的经不对称还原消除构建联芳基轴手性不同,在该不对称Suzuki−Miyaura偶联反应中,阻转选择性的转金属化步骤决定了产物的对映选择性,此发现进一步丰富了该诺奖反应的手性控制模式。
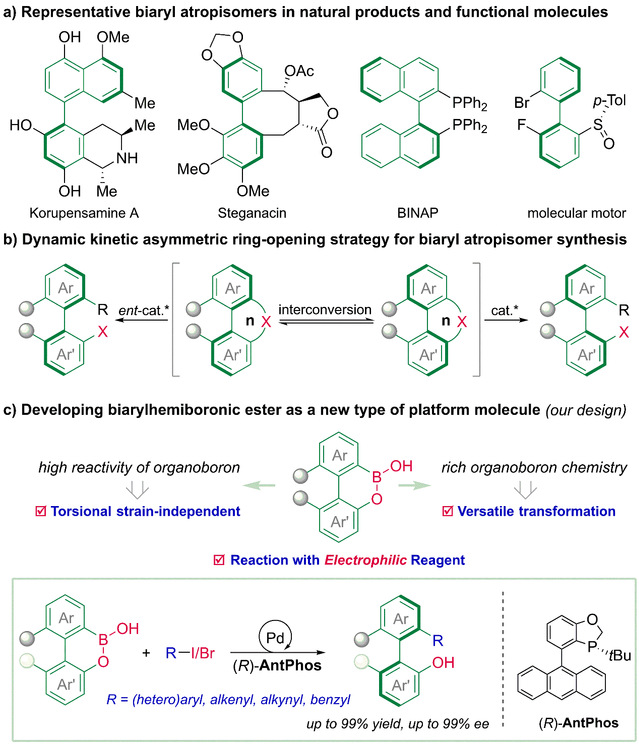
联芳基硼酸半酯的设计及反应开发示意图
该研究工作受到了江苏省自然科学基金优秀青年基金(BK20200080)的资助。
论文链接: https://pubs.acs.org/doi/10.1021/jacs.3c14450
(供稿单位:理学院,撰写人:王亚茹,审稿人:沈玲玲)





